

Laju reaksi adalah kecepatan proses terjadinya suatu reaksi, sehingga reaktan habis dan berubah menjadi produk reaksi.
Laju reaksi ada yang cepat dan ada yang berlangsung lambat.
Contoh laju reaksi berlangsung cepat adalah reaksi antara larutan asam dan basaatau reaksi pembakaran campuran bensin dan udara di dalam mesin kendaraan bermotor.
Sedangkan contoh laju reaksi yang berlangsung lambat adalah perkaratan besi, reaksi-reaksi kimia dalam tubuh, dan reaksi antara bahan cat dan oksigen.
Secara matematik, rumus umum laju reaksimerupakan perubahan jumlah molar zat per satuan waktu, ditulis sebagai berikut:
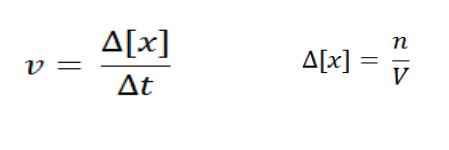
Di mana:
v = laju reaksi (M/s)
Δ[x] = perubahan konsentrasi molar zat (M)
Δt = perubahan waktu (s)
n = jumlah mol zat terlarut (mol)
V = volume larutan/ruangan gas (L)
Persamaan laju reaksi juga dapat dikaitkan dengan laju perubahan konsentrasisuatu reaktan, sehingga dapat ditulis sebagai berikut:
Pada reaksi : A + B → C + D
Nilai persamaan laju reaksi adalah sebagai berikut:
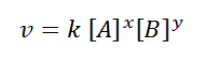
Di mana:
k = konstanta/tetapan laju reaksi
x = orde/tingkat reaksi terhadap A
y = orde/tingkat reaksi terhadap B
x + y = orde reaksi total